Бактерии-альтруисты помогают своим сородичам-каннибалам себя съесть
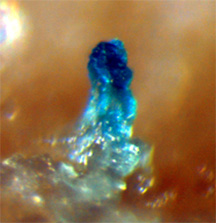 Расшифрован молекулярный механизм, регулирующий взаимоотношения в сообществе почвенных бактерий Bacillus subtilis. Их общественная жизнь полна драматизма: когда пищи становится недостаточно, одна половина бактерий убивает другую ядом. Погибшие служат пищей своим убийцам, которые не умирают от собственного яда благодаря особому защитному белку.
Расшифрован молекулярный механизм, регулирующий взаимоотношения в сообществе почвенных бактерий Bacillus subtilis. Их общественная жизнь полна драматизма: когда пищи становится недостаточно, одна половина бактерий убивает другую ядом. Погибшие служат пищей своим убийцам, которые не умирают от собственного яда благодаря особому защитному белку.
«Плодовое тело» Bacillus subtilis — сложный многоклеточный агрегат, часто образуемый дикими бактериями в природе, и почти никогда — в лаборатории (фото с сайта gasp.med.harvard.edu)
Группа ученых из Гарвардского университета в результате многолетних исследований выяснила генетическую подоплеку сложного социального поведения B. subtilis. Эти повсеместно распространенные почвенные бактерии относятся к числу наиболее хорошо изученных микроорганизмов. Геном «тонкой бациллы» прочтен еще в 1997 году. Его размер — 4 214 630 пар оснований, общее число генов — 4225, и функции большинства генов в общих чертах известны.
Этого, однако, недостаточно, чтобы понять механизмы, управляющие сложным поведением бациллы. Этот микроб, например, умеет при необходимости отращивать жгутики и приобретать подвижность; собираться в «стаи» (swarming behavior); принимать решения на основе химических сигналов, получаемых от сородичей; при этом используется особое «чувство кворума» (quorum sensing) — нечто вроде химического голосования, когда определенное критическое число поданных сородичами химических «голосов» меняет поведение бактерий. Мало того, B. subtilis способна собираться в многоклеточные агрегаты, по сложности своей структуры приближающиеся к многоклеточному организму.
В критической ситуации (например, при длительном голодании) бациллы превращаются в споры, устойчивые к неблагоприятным воздействиям, чтобы дождаться лучших времен. Но превращение в спору для B. subtilis — процесс дорогостоящий, требующий активизации около 500 генов, и эта мера приберегается на самый крайний случай. Ну а в качестве предпоследней меры в голодные времена микроб прибегает к убийству своих сородичей и каннибализму. Если, конечно, сородичей вокруг достаточно много, то есть плотность популяции высока. Если нет — тогда делать нечего, приходится превращаться в споры натощак.
Ученые выяснили, что при голодании у B. subtilis срабатывает особый генный переключатель, который может находиться лишь в одном из двух дискретных состояний (включено/выключено). «Переключатель» состоит из ключевого гена-регулятора Spo0A и нескольких других генов, которые взаимно активируют друг друга по принципу положительной обратной связи.
Активизация Spo0A приводит к целому каскаду реакций, в том числе к производству клеткой токсина SdpC, убивающего тех бацилл, у которых «переключатель» выключен. Тут вся хитрость в том, что голодание приводит к активизации Spo0A только у половины микробов. Погибшие клетки распадаются, высвободившиеся из них органические вещества всасываются убийцами. Если никаких перемен к лучшему так и не произойдет, они теперь, по крайней мере, будут превращаться в споры сытыми.
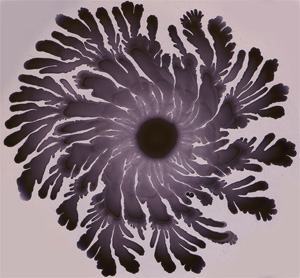 Многоклеточные агрегаты B. subtilis, образующиеся в результате сложного коллективного поведения, порой напоминают снежинки — частный случай фракталов (фото с сайта www.igmors.u-psud.fr)
Многоклеточные агрегаты B. subtilis, образующиеся в результате сложного коллективного поведения, порой напоминают снежинки — частный случай фракталов (фото с сайта www.igmors.u-psud.fr)
До сих пор было неясно, почему токсин убивает только тех бацилл, которые его не выделяют (то есть тех, у кого Spo0A не активирован). И вот что выяснилось. На мембране бацилл сидит защитный белок SdpI, выполняющий сразу две функции. Во-первых, он защищает клетку от токсина SdpC (просто хватает молекулы токсина и держит, не дает им ничего делать). Во-вторых, молекула белка SdpI, схватившая молекулу токсина, изменяется таким образом, что другой ее конец (торчащий из внутренней стороны мембраны) хватает и удерживает молекулы белка SdpR, функция которого состоит в том, чтобы блокировать производство защитного белка SdpI.
Таким образом, схватывание защитным белком молекулы токсина приводит к инактивации белка, тормозящего производство защитного белка. То есть чем больше будет токсина, тем больше клетка будет производить защитного белка. А как только токсин в окружающей среде закончится, молекулы SdpR перестанут инактивироваться, и производство защитного белка остановится.
По молекулярно-биологическим меркам это — крайне простой регуляторный каскад, проще некуда. Так бациллы защищаются от собственного токсина. А почему же бациллы с выключенным Spo0A оказываются незащищенными? Оказывается, синтез спасительного SdpI у них блокируется еще одним белком — AbrB. Отключить AbrB можно только путем включения Spo0A; поэтому клетки с выключенным Spo0A просто-напросто обречены.
На наш взгляд, самым интересным тут является даже не каннибализм бацилл-убийц, а альтруизм бацилл-жертв, которые отключают себе всё, что только можно, лишь бы помочь своим сородичам себя съесть.
Казалось бы, естественный отбор должен способствовать закреплению в потомстве признака «Spo0A включается при голодании» и отбраковывать особей с противоположным признаком. Действительно, ведь первые выживают и оставляют потомство, а вторые погибают, и так раз за разом, при каждой очередной голодовке. Однако генный «переключатель» упорно остается настроенным так, чтобы включаться при голодовке только в 50% случаев. Ведь если все особи в популяции захотят стать каннибалами, а жертвами — никто, то всё мероприятие потеряет смысл, есть будет некого. Интересы общества, как водится, оказываются выше личных, и каннибализм одних расцветает лишь благодаря альтруизму других.
Источник: C. D. Ellermeier, E. C. Hobbs, J. E. Gonzalez-Pastor, R. Losick. A Three-Protein Signaling Pathway Governing Immunity to a Bacterial Cannibalism Toxin // Cell. 2006. 124, 549–559.
Биология. Экология. Медицина. >> Статьи с иллюстрациями. >> Микроорганизмы.
Статьи по теме:
В африканских лесах найдена новая форма сибирской язвы. Споры возбудителя сибирской язвы чрезвычайно устойчивы к различным воздействиям.
Микроб Geobacter производит бионаноэлектропровода. Обитающие в сточных водах микроорганизмы повышают электропроводность.
Новая профессия старой бактерии. Бактерия рода Desulfitobacterium очищает сточные воды и производит электричество.
Бактерии, устойчивые к антибиотикам заражают собой грунт и воду. Это может приводить к появлению стойких форм кишечных бактерий типа сальмонеллы.
Авитаминоз будут лечить не приемом витаминов, а увеличением эффективности всасывания минеральных веществ кишечными клетками. Применение культуры Lactobacilli.
Социальный иммунитет и цена за жизнь в группе. Коллективные животные больше подвержены инфекционным заболеваниям, но живущие в колониях имеют и ряд преимуществ.
Разделы сайта:
-
psy.tom.ru/bio - Биология, физиология - статьи, рефераты, новости.
psy.tom.ru/index - Психология, физиология, медицина - статьи.
psy.tom.ru/psy - Психология, этология - новости, короткие статьи.
psy.tom.ru/med - Медицинские исследования, факты, новости.
psy.tom.ru/diet - Диеты, норма питания - исследования, новости.
psy.tom.ru/meteo -Экология, метеорология, климатология - статьи.
psy.tom.ru/photo - Статьи с иллюстрациями (рефераты, фотографии).
Copyright © В.А. Иванов, 2003-2006
Главная страница Содержание Комментарии Информация о сайте Поиск на сайте
Обновления Ссылки English version